EY新日本有限責任監査法人 ライフサイエンスセクター
公認会計士 冨田 哲也/小山 晃平
永岡 明典/松原 匠作
3. 業界のトレンド
ライフサイエンス業界は急速に変化しており、最新の技術とイノベーションが医療、製薬、バイオテクノロジーに大きな影響を与えています。また、持続可能な医療制度の構築も重要な課題であり、各国の医療・社会保障政策にも大きな影響を受けます。
ここでは、ライフサイエンス業界を取り巻く環境変化やトレンドについて、特に重要なものを取り上げて解説します。
(1) 薬価の形成プロセスと関連する規制
薬価の形成は医薬品市場における重要な要素で、価格が適切で公平であることが確保される必要があります。このプロセスは各国で異なり、政府による規制、市場競争、保険制度など多くの要因に影響されます。薬価規制は医療費のコントロールや医薬品に対するアクセス向上を目指し、患者へのアフォーダビリティを確保するために存在します。
下記では、主要な市場である日本、米国、EU、中国における薬価の形成プロセスと関連する規制の概要について解説します。
| 日本の医薬品市場: |
日本における医薬品の承認プロセスでは、PMDAが薬事承認の申請を審査し、安全性、有効性、品質に関する専門的な評価を行った後、厚生労働大臣によって最終的に薬事承認が認可されます。また、厚生労働省が薬価の規制を行っており、新薬の薬価は所定のプロセスを経て薬価基準と呼ばれる価格表に収載されます。 ここで言う薬価とは、医師の診療に基づき医療用医薬品を医療機関が用いた場合に国及び患者に請求する価格のことであり、一方で、医療機関が医療用医薬品を卸業者から仕入れる際の価格は、当事者間で自由に設定できます。 そのため、厚生労働省は定期的に、医療機関が卸業者から医療用医薬品を仕入れる際の価格(「市場実勢価格」と言います)を調査し、市場実勢価格と薬価の価格差(「乖離率」と言います)が大きい場合には薬価を引き下げることがあります。 このようなプロセスを薬価改定と呼び、2021年以降は毎年度行われています。 なお、医薬品の流通管理に必要な配送料等の必要経費として、改訂前薬価に対して2%のマージンは維持されるように調整されます(「調整幅」と言います)。 薬価改定により薬価が引き下げられる場合、医療費負担は軽減されますが、その分医療機関の収益(薬価差益)や製薬企業の収益性が悪化することとなり、革新的な新薬開発へのモチベーションが低下する可能性があるほか、他国と比較した場合に市場全体の魅力が低下する可能性があります。 |
| EUの医薬品市場: |
EUにおける医薬品の承認プロセスでは、開発者がEMAに承認を申請すると、EMAによる科学的な審査を経て欧州委員会が最終的な承認を決定し、各加盟国はEUの医薬品承認に基づいて国内での販売を許可します。 EUでは、各加盟国が独自の医薬品価格規制を行っており、薬価が国ごとに異なりますが、価格の透明性が重視されており、薬価設定や価格比較に関する情報の公開が行われる点が特徴的です。 EU全体での医薬品制度に係る最新動向として、医薬品の価格透明性を高めるための規制の強化を含む制度改革案が2023年4月に提案されており、企業に対し、医薬品の開発にあたって受領した公的資金を含む一部の研究開発費を承認申請時に開示することを義務付けることが検討されています。 この改正によって医薬品の価格に関する透明性がより向上し、加盟国が行う製薬企業との価格交渉に有益な情報が提供されると期待されています。 |
| 米国の医薬品市場: |
米国において、医薬品の安全性と有効性はFDAが評価及び承認しており、FDAによって承認されると医薬品としての販売が可能となります。 米国の医薬品市場では、政府が規制する一律的な薬価は存在しておらず、医薬品メーカーは自由に薬価を設定することが可能であり、薬価は市場原理に従って形成されます。 患者が直接医薬品メーカーから医薬品を購入するケースもありますが、医療保険が介在する形での医薬品入手が一般的であり、メディケア、メディケイドといった公的保険プログラムや民間の保険会社は、加入者の利益を保護し費用負担を軽減するために、価格交渉や保険の適用範囲(カバレッジ)の決定を通じて医薬品メーカーや医療機関と交渉を行います。 メディケイドは、低所得者や一定の条件を満たす人々に対して提供される州と連邦の共同医療保険プログラムであり、メディケアは、65歳以上の高齢者および一部の障害者に提供される連邦政府の医療保険プログラムです。 米国においても医療コストの増加が持続的な財政上の課題となっており、2022年に成立したインフレ削減法では、メディケアの価格交渉権が強化されメディケアが医療機関や医薬品メーカーと直接価格交渉を行うことが可能となりました。 |
| 中国の医薬品市場: |
中国において、医薬品承認制度はNMPAが管轄しており、NMPAによって承認されると医薬品としての販売が可能となります。 中国も、日本と同様に薬価の設定および変更についての審査機関が存在しており、NMPAと国家医療保健品質管理局(NHSA)が薬価の審査を担当しており、薬価の定期的な見直しが実施されます。 また、中国でも医療コストを抑制することが医療保険制度の持続可能性を確保するための重要な課題となっており、医療制度の改革と医薬品価格のコントロールを目的として2018年から医薬品の量的調達プログラム(Volume-Based Procurement Program、VBP)が実施されています。 VBPでは、公立病院や地方政府等の大規模な購買団体が競争入札方式で医薬品メーカーから医薬品を一括で購入し、小規模な医療機関や病院は通常、これらの大規模な団体から医薬品を調達します。 小規模な医療機関は、大規模な購買団体が獲得した競争力のある価格を利用し、医薬品を入手することができます。医薬品メーカーは、まとまった数量の医薬品の販売が可能となる一方で、入札を通じて価格競争が促進されることで、医薬品のコストが低下します。 |
(2) 医薬品業界のモダリティ
ライフサイエンス業界の特徴として、近年の科学技術、情報技術の発展により、遺伝子療法や再生医療などの革新的な治療法や医薬品の開発が進められています。この章では医薬品のモダリティについて解説します。ここで「モダリティ」というのは、医薬品の種類、カテゴリーという意味で使用しています。
従来の医薬品は低分子の化学物質を用いて病気を治療するものが主流でした。1980年頃より遺伝子工学の技術が発展し、遺伝子が持つ様々な特性が明らかになったことから、1990年代に入り、体内で標的分子(抗原)と結合して受容体への結合を阻害し病気を治療する抗体医薬品や、病気の原因となるタンパク質を生み出すmRNAの活動を阻害して病気を治療する核酸医薬品がFDAで初めて承認されました。また2010年代後半には、遺伝子を用いて治療する遺伝子治療や、遺伝子操作された細胞を用いて治療を行う遺伝子細胞治療がFDAで初めて承認されました。これらのバイオ技術を用いた医薬品群は、従来の低分子の医薬品では治療が出来なかった病気を標的とすることができる可能性があり、積極的に創薬が進んでいる分野であり、新規承認医薬品におけるモダリティとして一定の存在感を築いています。
また、近年、患者数が少ない希少性疾病を標的とした医薬品(オーファンドラッグ)の承認も続いています。過去、希少性疾病については、患者数が少なく、開発コストの回収が見込めないことから積極的な開発が行われることがありませんでしたが、1983年に米国で、日本では遅れて1993年に制度改訂がなされたことにより、様々な優遇措置を受けることができるようになり、製薬会社は日々開発に取り組んでいます。
更に、医薬品とは異なりますが、2010年代より、新しい医療形態として、培養増殖した幹細胞を体内に移植することにより機能的・器質的に障害された臓器や組織の改善や修復を目指す医療である再生医療についても実用化が始まりました。再生医療については、薬機法の制定において医薬品等に「再生医療等製品」というカテゴリーが新設されたことと合わせて、「再生医療等の安全性の確保等に関する法律」(安確法)において、再生医療等の安全性の確保に関する手続きや細胞培養加工の外部委託のルール等が定められています。
また、2020年代に入り、医療技術とデジタル技術を組み合わせたコンピューター支援医療であるデジタルメディスンという新しい医薬品等も出現しました。患者のデータ収集やモニタリング、診断、治療に役立ち、医療の効率性と品質を向上させることを目指しています。デジタルデータを利用することで、患者への個別化されたケアを提供することを可能とし、医療の未来を変える可能性が期待されます。
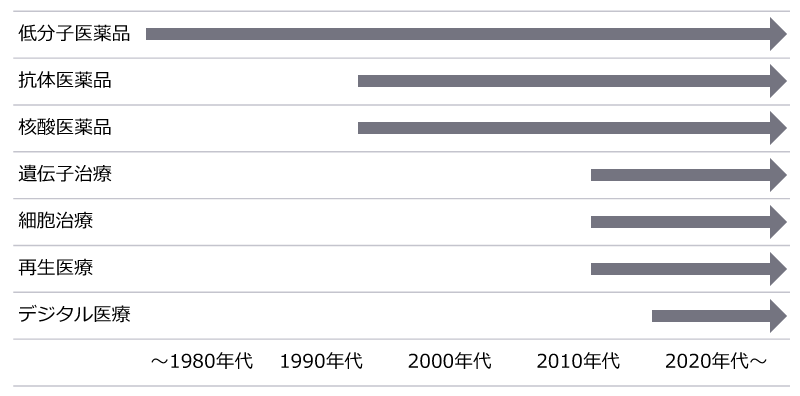
画像4【モダリティの変遷】執筆者作成
このように、情報技術の発展に伴う人工知能の活用や3Dモデリング技術の発展等による最新の開発手法を用いた新薬の研究が進んでいます。これらの新しい技術の発展により、今後も従来のモダリティの枠にとらわれない新しい医薬品が誕生してくることが予測されます。
(3) M&Aやパートナーシップ
医薬品には一定の特許期間が定められており、医薬品の特許が切れた時点で安価な後発医薬品に市場が置き換わるという製品ライフサイクルがあります。この特許切れにより新薬の売上高が大きく下落する現象は、その下落を崖になぞらえ「パテントクリフ」と呼ばれます。そのため、製薬会社は常に収益の柱となる多額の利益が望める新薬を求めています。特に年間売上高で10億ドル以上の収益をもたらす新薬は「ブロックバスター」と呼ばれ、長年の間、製薬会社は自社の研究開発により、様々なブロックバスターとなる新薬を生み出してきました。
しかしながら、近年では前述したようなモダリティの変化もあり、自社開発型の研究開発に限界を感じた大手製薬会社により、開発技術力のある大学発ベンチャー企業や、バイオ医薬品の開発技術力を持つ企業の買収が盛んに行われています。また、M&Aに限らず、パートナーシップ契約によるオープンイノベーション型の開発や、テクノロジー系企業との提携によるデジタル技術を用いた開発なども行われています。
前述の通り、大手製薬企業は常にパテントクリフによる収益低下の波をいかに乗り越えるかという課題を抱えていますが、近い将来、バイオ医薬品を中心に製品の特許切れが相次ぐ予定です。例えば、、2026年には血栓塞栓症治療薬であるエリキュース(ブリストル・マイヤーズ・スクワブ)、2028年にはがん治療薬のキイトルーダ(メルク)、オプジーボ(ブリストル・マイヤーズ・スクワブ)といった年間販売高50億ドルを超える大型製品が特許切れを迎えます(特許切れの時期は米国の特許期間に基づき算定)。これらのブロックバスターの販売により利益を蓄積してきた大手製薬企業は、他の企業を買収するだけの十分な資金量(ファイヤーパワー)を確保しており、下表の通り、2018年以降でも既に買収対価が100億米ドルを超えるような大型のM&A案件が多数発生しており、今後も大型の買収案件が起こることが予測されます。また、日本の大手製薬企業についても、潤沢な資金を利用して海外の製薬会社に対して大型のM&Aを仕掛けるケースも増えています。
また、買収候補となるターゲット企業としては、新薬やバイオテクノロジー、デバイスだけではなく、人工知能やビックデータ、ロボット工学などのセクター外の革新的テクノロジーも含まれて来ると考えられています。
図表5【2018年以降の大型M&A】医薬品業界の各社公表のM&A情報より、取得価格が200億米ドル超の案件より執筆者作成
| 完了日 | 買い手 | ターゲット企業 | 取得価格 (百万米ドル) |
ターゲット企業の事業領域 |
| 2018/6/7 | バイエル | モンサーント | 63,000 | 総合化学 |
| 2018/5/8 | 武田薬品工業 | シャイアー | 58,797 | バイオテクノロジー |
| 2019/11/20 | ブリストル・マイヤーズ・スクワブ | セルゲン | 74,000 | ガン治療 |
| 2020/3/31 | ダナハー | GEバイオファーマ | 21,400 | バイオテクノロジー |
| 2020/5/8 | アッヴィ | アラガン | 63,533 | 美容医療 |
| 2020/10/23 | ギリアド | イミュノメディクス | 21,000 | ガン治療 |
| 2021/7/21 | アストラゼネカ | アレクシオン | 39,000 | バイオ・希少疾患治療 |
| 2023/10/6 | アムジェン | ホライゾン・セラピューティクス | 27,800 | バイオ・希少疾患 |
| 2023/12/14 | ファイザー | シージェン | 43,000 | ガン治療 |
図表6【2018年以降の大型M&A(日本)】医薬品業界の各社公表のM&A情報より、取得価格が2,000億円超の案件より執筆者作成
| 完了日 | 買い手 | ターゲット企業 | 取得価格 (百万円) |
ターゲット企業の事業領域 |
| 2018/5/8 | 武田薬品工業 | シャイアー | 6,395,840 | バイオテクノロジー |
| 2019/12/27 | 住友ファーマ | スミトバント | 219,360 | バイオテクノロジー |
| 2020/1/15 | アステラス製薬 | オーデンテス | 329,850 | バイオテクノロジー |
| 2023/2/8 | 武田薬品工業 | ニンバス・ラクシュミ | 785,580 | 自己免疫疾患 |
| 2023/3/10 | 住友ファーマ | マイオバント | 231,217 | ガン・婦人科 |
| 2023/7/11 | アステラス製薬 | アイベリック バイオ | 838,575 | 眼科 |
参考文献・参考ウェブページ
厚生労働省HP www.mhlw.go.jp/index.html(2023年12月)
独立行政法人 医薬品医療機器総合機構HP www.pmda.go.jp/(2023年12月)
U.S. Food and Drug Administration www.fda.gov/(2023年12月)
European Medicines Agency www.ema.europa.eu/en/homepage(2023年12月)
国家薬品監督管理局 www.nmpa.gov.cn/(2023年12月)
ライフサイエンス
- 第1回:ライフサイエンス業界の概要と動向(上) (2024.03.05)
- 第2回:ライフサイエンス業界の概要と動向(下) (2024.03.06)
- 第3回:新薬を中心とした医療用医薬品製造販売業の概要と会計処理の特徴 (2024.03.08)
- 第4回:一般用医薬品製造販売業の概要と会計処理の特徴 (2024.03.11)
- 第5回:ジェネリック医薬品(後発医薬品)を中心とした医療用医薬品製造販売業の概要と会計処理の特徴 (2024.03.13)
- 第6回:医薬品製造受託機関(CMO)・医薬品開発製造受託機関(CDMO)の概要と会計処理の特徴 (2024.03.14)
- 第7回:医療機器製造販売業の概要と会計処理の特徴 (2024.03.15)
- 第8回:医薬品卸売業の概要と会計処理の特徴 (2024.03.18)
- 第9回:バイオベンチャー企業のビジネスと財務諸表の特徴 (2024.03.25)
- 第10回:バイオベンチャー企業におけるライセンス契約の会計処理論点 (2024.03.26)
- 第11回:ライフサイエンス関連企業における不正・コンプライアンスリスクと最近の動向 (2024.03.27)
- 第12回:バイオベンチャー企業の株式上場における論点 (2024.03.28)
- 第13回:ライフサイエンス関連企業のサステナビリティ情報開示 (2024.04.02)




